近日,国家药品监督管理局(NMPA)官网公开信息显示,已批准吉因加自主品牌国产基因测序仪Gene+Seq-2000和Gene+Seq-200的适用范围变更申请。两款仪器分别于4月14日和4月27日通过审批,新增“对核糖核酸(RNA)进行测序”的适用范围。这标志着Gene+系列测序平台临床应用范围进一步拓展,将更好用于病原RNA检测,临床肿瘤、遗传病等RNA检测或其他特定领域;同时推动NGS技术在临床合规落地,助力更多临床获益。

Gene+Seq-2000和Gene+Seq-200基因测序仪
全面覆盖DNA和RNA测序的需求
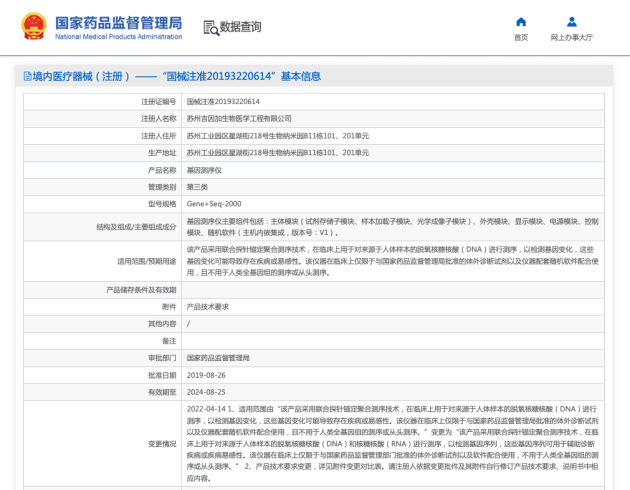
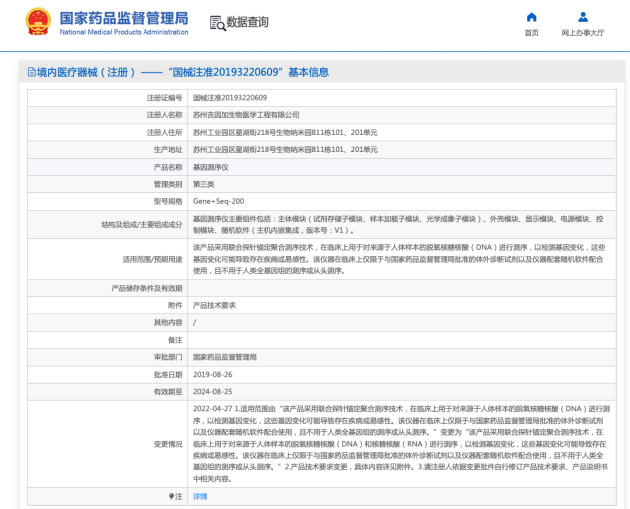
Gene+Seq-2000/200基因测序仪新增RNA测序适用范围(来源:NMPA)
至此,Gene+Seq-2000和Gene+Seq-200基因测序仪成为国内第2家拥有“对来源于人体样本的核糖核酸(RNA)进行测序”适用范围的基因测序平台。这两款基因测序仪适用范围的扩大,将满足临床及行业对来源于人体样本的核糖核酸(RNA)进行测序的需求,包括但不限于肿瘤融合基因检测、全转录组检测、病原RNA检测等多种RNA测序的需求,真正实现DNA和RNA基因测序需求的全覆盖。
全面适用肿瘤和病原等多种应用场景
变更后,Gene+Seq-2000和Gene+Seq-200基因测序仪适用范围包括“在临床上用于对来源于人体样本的脱氧核糖核酸(DNA)和核糖核酸(RNA)进行测序”。这意味着,吉因加测序平台不仅可对人体样本的DNA和RNA测序,还可对来源于人体的其他样本进行测序,譬如来源人体的病原DNA和RNA。这一点也区别于市面上多数测序平台仅可检测人的DNA的要求,从而将测序应用场景全面扩展到肿瘤基因检测、病原宏基因组检测、新冠溯源和监测以及遗传病致病基因检测等方向。
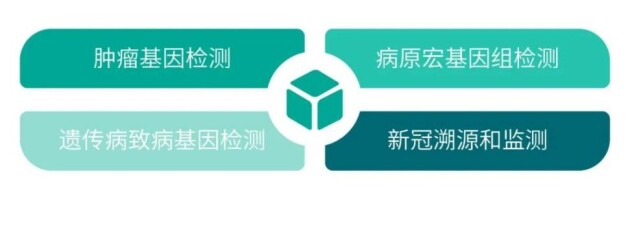
Gene+Seq-200/2000基因测序仪应用场景
打造国产NGS平台临床应用的引领者
除了此次获批新增适用范围的自主品牌测序仪,以及获批NMPA三类和二类证书的吉因加人EGFR/KRAS/ALK基因突变检测试剂盒、Gene+OncoBox肿瘤NGS全自动分析解读一体机配套软件,公司还精心整合了实验室设计与布局、流程规划、质量管理体系搭建、人员培训、技术支持等全流程运营服务,能全面合规地助力医院端和行业端国产NGS测序平台的稳定运营。
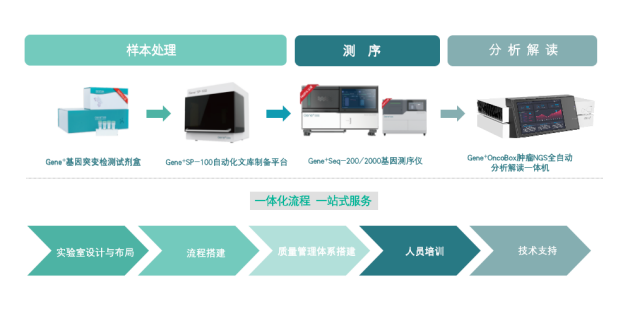
Gene+Seq-200/2000基因测序仪应用场景
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
关键词:




